牙齿由上皮和间充质细胞间的相互作用发生(图1),通过胚胎牙上皮和间充质干细胞已可以功能性重建和再生牙齿,使牙齿的原位全器官置换成为可能。然而人类牙齿萌出后上皮干细胞数量缺失,导致使用上皮干细胞进行牙齿修复极为困难,牙齿再生机制研究模型的发展也受到限制。
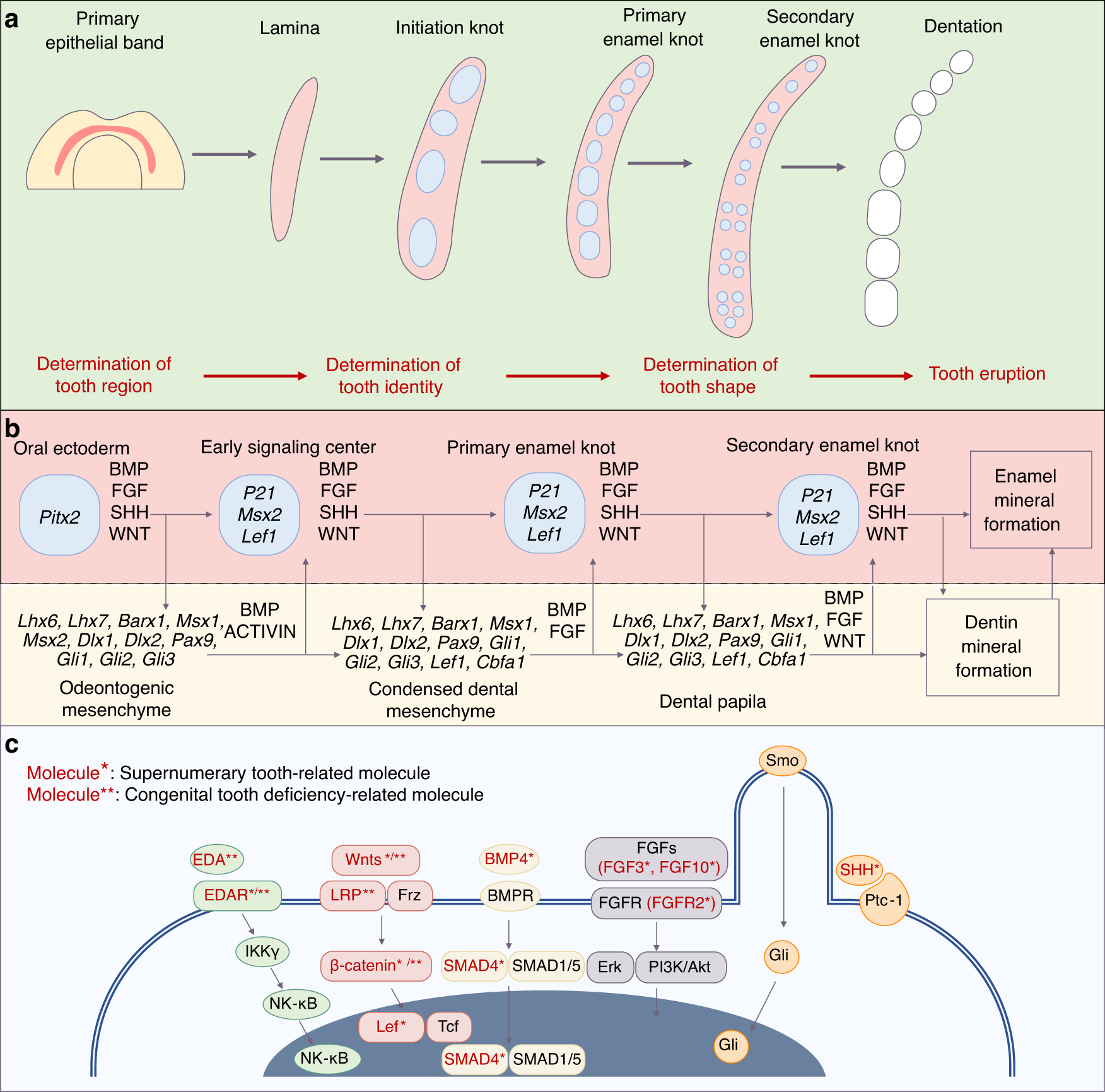
图1:牙齿的发育过程及关键信号通路
(来源:参考资料[1])
牙齿类器官因具有与牙齿类似的结构和一致的功能,已经成为体外研究牙齿发育的重点模型。2023年的两项研究通过人类诱导多能干细胞(hiPSC)成功构建了人类成釉细胞(负责产生和分泌牙釉质)类器官。该模型可与牙间充质相互作用形成牙釉质以进行钙化和矿化,并具有成牙分化潜能[2,3]。
小鼠牙上皮干细胞在整个生命过程中维持存续,且由于哺乳动物的牙齿发育相关信号具有高度类似性,已成为主要的牙齿发育研究模型。然而,在常用的胎牛血清(FBS)培养基中无法准确定义生长因子及代谢物对牙齿发育的意义。比利时科学家基于小鼠上皮干细胞开发了可长期培养的牙齿类器官,并验证了无血清培养体系的可行性[4]。不同于hiPSC发展的类器官模型仅停留在上皮来源的成釉细胞阶段,小鼠牙齿类器官覆盖了成釉细胞和间充质来源的成牙本质细胞两类细胞的相互作用,有助于探索牙齿矿化及重建的分子基础。
2024年11月27日,四川大学李中瀚教授课题组在期刊Advanced Science上发表题为“A chemically defined culture for tooth reconstitution” 的研究论文。本研究在确定成分的无血清化学培养基上进行了小鼠来源牙齿类器官的重建,并依据此模型,发现牙齿重建并不重置发育时钟。研究团队随后在气-液界面上通过Activin A和SHH途径激动剂SAG的持续共刺激进一步激发了早期体外类器官的发育潜力,并揭示了骨形态发生蛋白BMP诱导牙釉质形成的重要作用。该研究优化了模拟牙齿重建的体外类器官模型的培养条件,对未来的牙齿发育机制研究与再生移植具有重要意义。

(来源:参考资料[4])
01 牙齿类器官构建
研究团队从不同发育阶段的小鼠牙胚中分离原代上皮和间充质细胞,发现与FBS培养基类似,牙齿培养物在无血清化学培养基上也能够持续成长,并同样出现了由间充质细胞包围的多个上皮细胞团和牙胚样结构。
接下来,移植获得的牙齿类器官至肾被膜下,发现胚胎来源的类器官均可形成牙状体结构,且解剖结构与PN7(胎儿第7天)的M1臼齿类似。定量分析结果显示,多个胚胎阶段的原代细胞可以在无血清化学培养基中重建牙状体,这种能力在出生后消失。
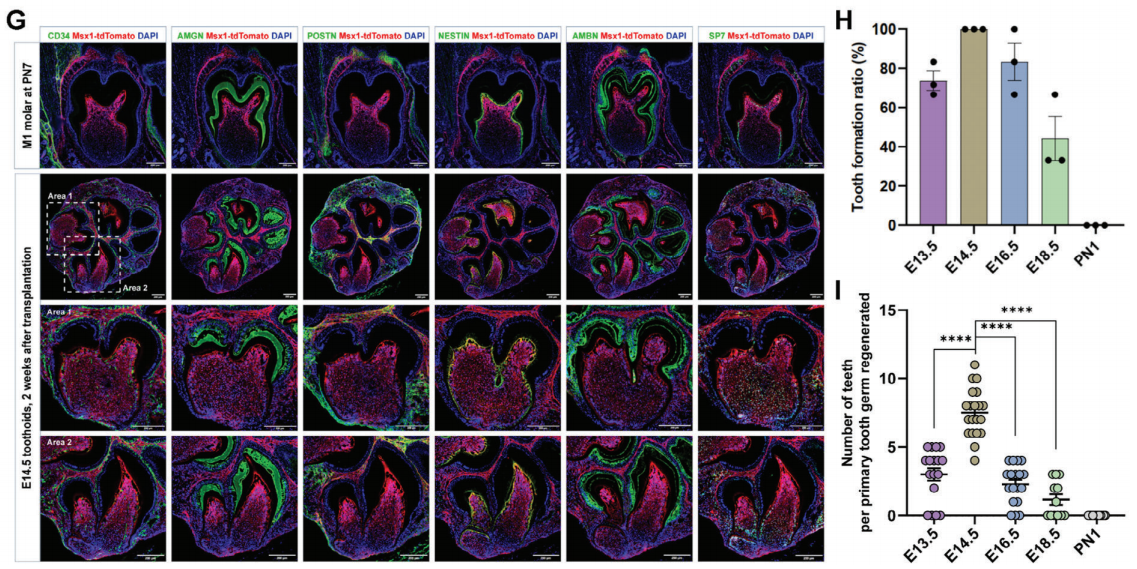
图2:不同阶段细胞分化为牙齿类器官的能力对比
(来源:参考资料[4])
比起臼齿而言,相同培养系统培养的切齿类器官中产生的牙齿数量更少,而生成的牙状体结构更大,且E18.5及更晚期来源的切齿牙胚不具有发育成切齿的能力。这表示切齿比臼齿发育更快,并更早地失去重建分化的潜力。
02 牙齿类器官验证与机制研究
研究人员发现,E14.5牙齿类器官中,发育标记如间充质祖细胞Msx1+Sox9+的发育轨迹和SDC1的动态表达模式均类似于天然M1臼齿。稍有差异的是,原发釉结(牙发育的组织中心)在培养第4-10天内发生,但继发釉结始终未检出,可能是自组织牙胚的尺寸限制导致了这一现象。
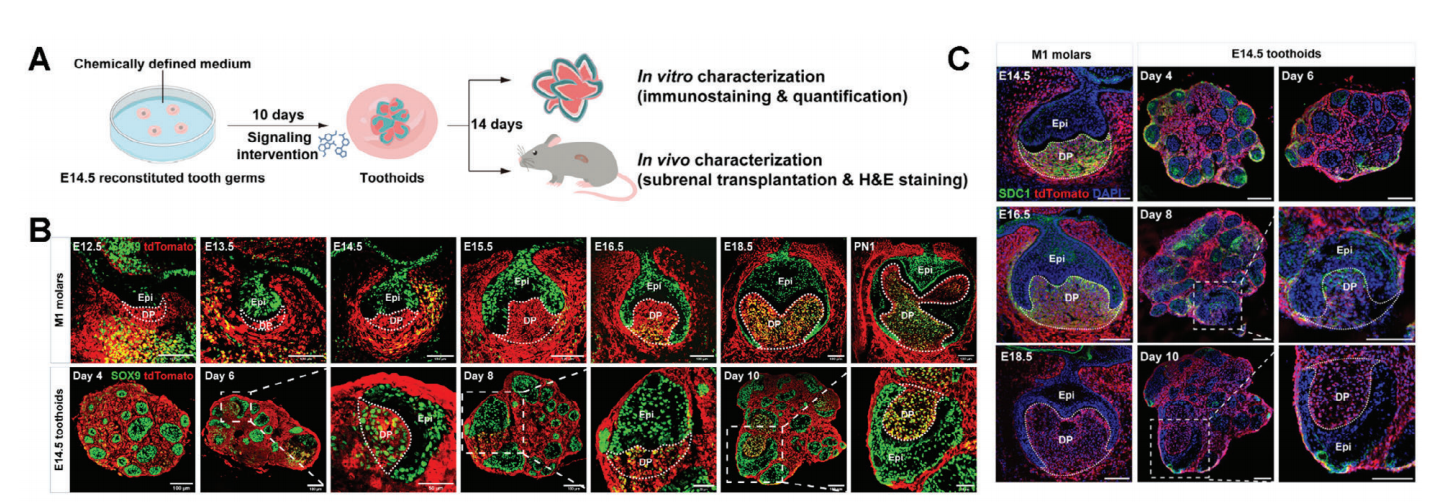
图3:牙齿类器官的发育鉴定
(来源:参考资料[4])
继续培养牙齿类器官至第24天,scRNA-seq数据分析发现了多种阶段特异性牙齿标记物的时序性表达。除E14.5外,来自多个其他阶段的牙齿类器官也可以持续发育并产生成熟牙齿细胞的谱系。
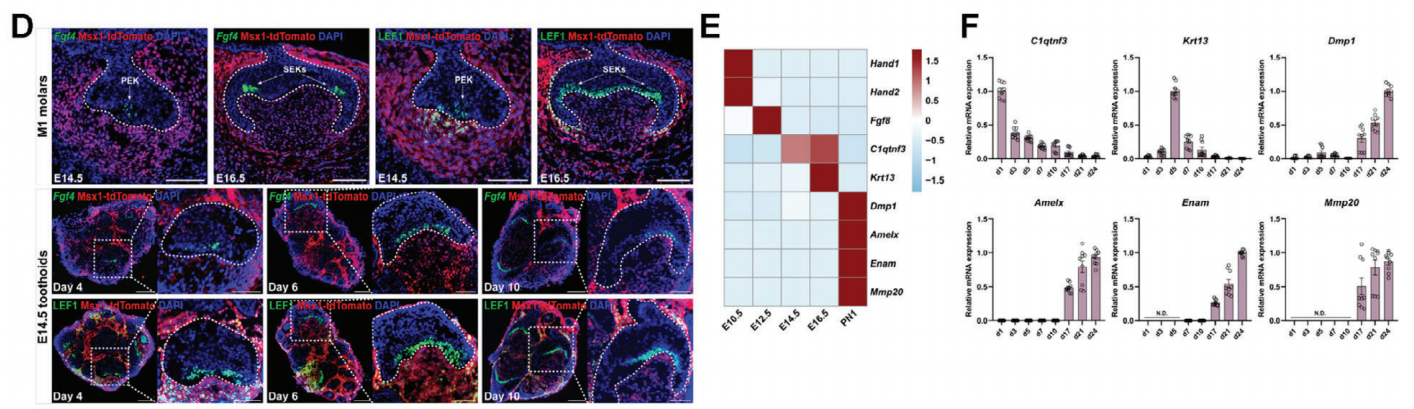
图4:类器官中牙齿标记物的时序性表达
(来源:参考资料[4])
此外,研究人员通过抑制关键信号通路发现,牙齿类器官也会响应其化学调节。当抑制ALK5时,类器官中牙齿形成减少;阻断Wnt会抑制牙齿形成并增加表皮化;而激活Wnt信号传导会诱导多个牙本质-牙髓复合体和牙釉质样结构的形成。
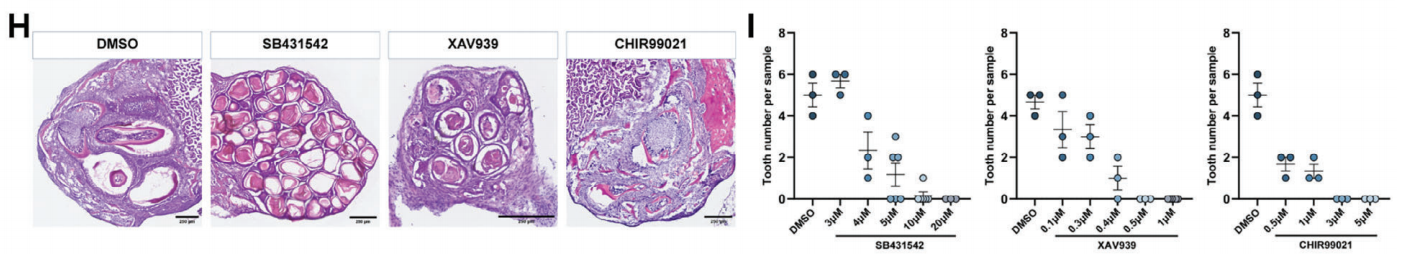
图5:牙齿类器官中的信号通路的调控
(来源:参考资料[4])
综上所述,化学培养基中获得的牙齿类器官可以重现正常的牙齿发育过程,并拥有与正常牙齿发生类似的关键信号通路,可作为发育和重建机理的研究模型。
牙齿重建并不重置发育时钟
以此牙齿类器官为模型,研究人员很快发现,牙齿发育不同阶段的标志物仅在各阶段特异性表达,晚期阶段均未检出早期阶段的标志物,这意味着牙齿重建并不是通过重置发育时钟的方式进行。
03 多种生长因子促进早期牙胚的牙齿重建
Activin A和SAG持续共刺激
虽然E12.5及之后阶段的牙胚可以通过化学培养基及移植获得牙齿结构,但早期牙胚诱导牙齿形成的能力保持不长久。为改良这一问题,研究人员探索了牙齿发育的早期重要信号Activin A,促进上皮细胞增殖和侵袭所必需的SHH信号,以及上文已经提及的Wnt信号的刺激作用。
结果发现,三种信号刺激可以诱导牙齿的生成,且当Activin A和SAG(SHH途径激动剂)加入培养基后,原代组织发育形成牙齿的数目最多。此外,Activin A和SAG的持续共刺激有助于在体外牙齿类器官培养期间保持发育潜力。
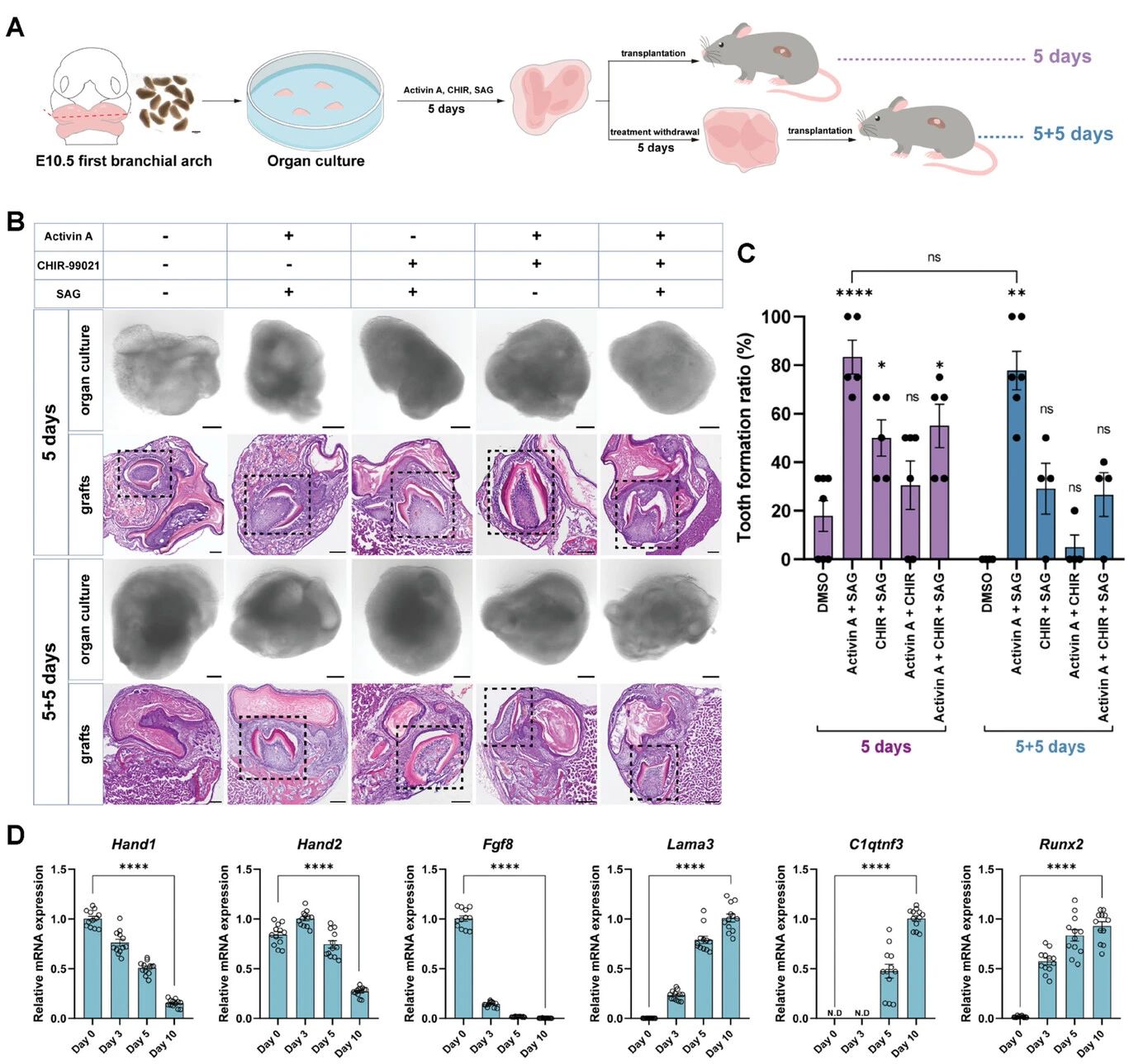
图6:多重关键通路刺激诱导初期牙胚的牙齿重建
(来源:参考资料[4])
气-液界面培养中,BMP助力牙釉质生成
为此,研究人员将类器官转移到气-液界面用于进一步诱导,然而牙釉质却并没有生成。研究团队发现,抑制BMP信号会强烈抑制牙釉质诱导且该过程呈剂量依赖性。单独激活BMP信号可促进牙釉质生成。除此以外,TGF-β1激活剂也可协同增强牙釉质的形成。
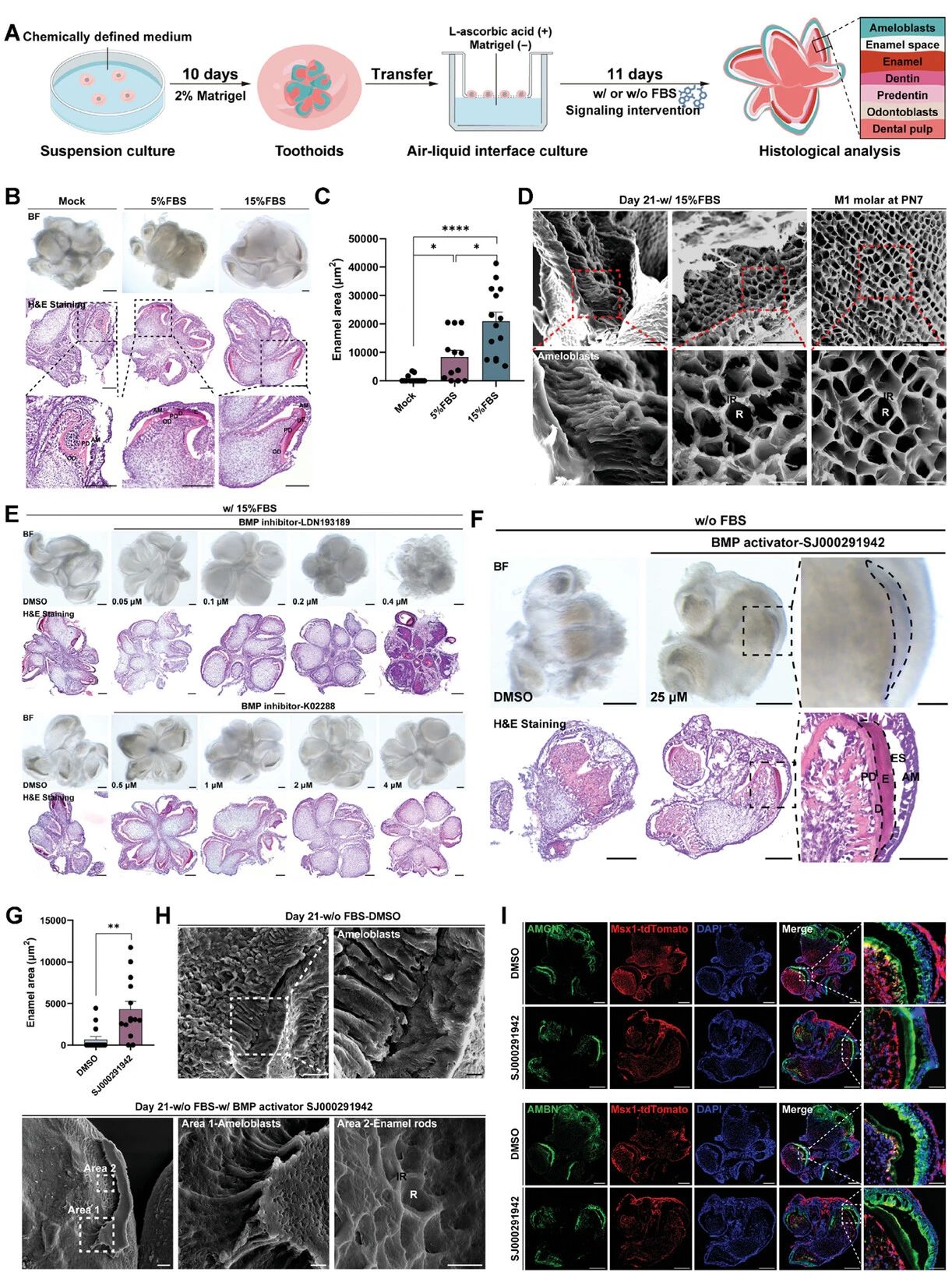
图7:BMP诱导牙釉质生成
(来源:参考资料[4])
04 结论与展望
本研究中,多个胚胎阶段的牙胚细胞可在化学无血清培养基上生成牙齿类器官,并在移植肾被膜下后发育成臼齿或切齿样结构。该类器官模型与牙齿具有一致的发育特征,且关键信号通路保守,可用于体外研究牙齿重建的机制。基于此,研究人员随后发现,牙齿重建并不重置发育时钟,原代细胞从最初剥离的阶段继续开始发育。此外,研究人员还探索了刺激早期牙胚发育的因素,发现Activin A和SAG的共刺激至关重要,而BMP/TGF-β信号的激活是成釉细胞分泌细胞外基质和形成成熟牙釉质组织的关键触发因素。
不过,目前为止的牙齿类器官仍依赖于原代细胞而非多能干细胞,难以长期保持增殖状态,此外,也无法体外诱导牙根发育(尽管保留有牙根发育的全部潜力)。研究人员指出,微环境的信号可能对体外诱导至关重要,而牙齿类器官与神经嵴细胞结合或可进一步助力在体外产生完全发育的牙齿。未来在这些方面的探索,将进一步助力对牙齿重建机制的深入了解,推进人类牙齿临床替代的更多可能。
近岸蛋白具备多种经类器官培养验证的细胞因子,让您的类器官培养更可控!
参考资料
1.Zhang, Han et al. “Tooth number abnormality: from bench to bedside.”International journal of oral sciencevol. 15,1 5. 6 Jan. 2023, doi:10.1038/s41368-022-00208-x
2.Kim, Ka-Hwa et al. “Fabrication of functional ameloblasts from hiPSCs for dental application.” Frontiers in cell and developmental biology vol. 11 1164811. 29 Jun. 2023, doi:10.3389/fcell.2023.1164811
3.Alghadeer, Ammar et al. “Single-cell census of human tooth development enables generation of human enamel.” Developmental cell vol. 58,20 (2023): 2163-2180.e9. doi:10.1016/j.devcel.2023.07.013
4.Hermans, Florian et al. “Organoids from mouse molar and incisor as new tools to study tooth-specific biology and development.”Stem cell reportsvol. 18,5 (2023): 1166-1181. doi:10.1016/j.stemcr.2023.03.011
