结直肠癌(CRC)是全球第二大致死性癌症,从基因组层面而言主要由染色体不稳定性(CIN)或微卫星不稳定性(MSI)引起。MSI指当基因错配修复功能(MMR)受损时,DNA复制过程中的碱基错配大量积累的现象,因而也被称为错配修复缺陷(d-MMR)。驱动两种基因组不稳定性的突变不同:CIN由APC、TP53、KRAS、SMAD4和PIK3CA突变引起;MSI型CRC则与AXIN1、AXIN2、ACVR2A、TGFBR2、BMPR2和BRAF突变紧密相关。
1990年,美国科学院院士Vogelstein和Fearon教授提出Vogelgram模型[1],描述了CRC腺瘤-癌症序列发展进程同遗传及基因组变化之间的联系(图1)。不过,考虑到CRC整个癌变过程往往历时数十年,其腺瘤-癌症序列难以在体外被完整捕捉,真实可靠的体外模型尤其匮乏。
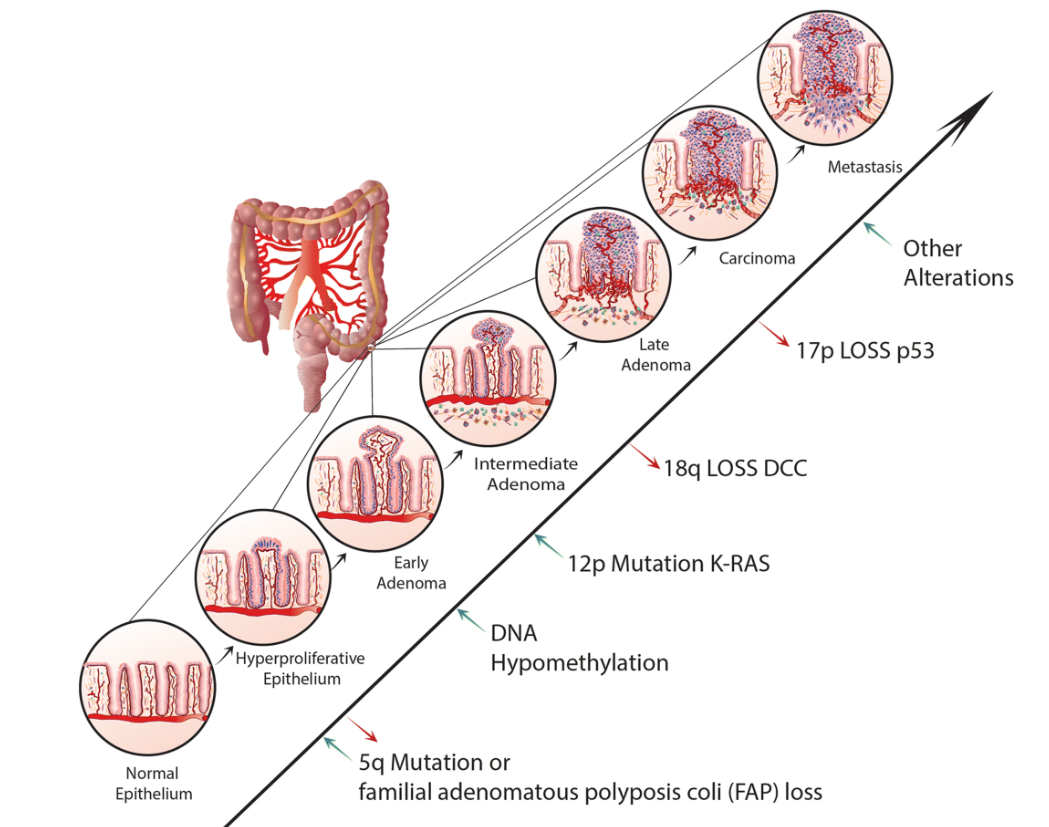
图1:结直肠肿瘤发生的遗传模型Vogelgram
(来源:参考资料[2])
2024年11月1日,荷兰乌特勒支大学Hans Clevers教授团队在期刊Nature Cancer发表了题为“Recapitulating the adenoma–carcinoma sequence by selection of four spontaneous oncogenic mutations in mismatch-repair-deficient human colon organoids”的研究论文,首次基于类器官模型在体外跟踪描述了CRC腺瘤-癌序列发展中涉及到的四种关键信号通路突变。研究证明,这些突变中Wnt通路首先发生,p53、BMP通路及EGFR通路紧随其后,相应的突变基因及点位得到阐述。通过生长因子的连续剥夺和添加,本研究成功筛选出自发突变的肿瘤类器官,并在移植小鼠后于体内成功诱导CRC发生,再次强调了该平台作为体外腺瘤-癌序列发展研究模型的可靠性。

(来源:参考资料[3])
01 d-MMR类器官模型建立
Wnt、EGFR、BMP、p53等通路的激活或抑制已被证明与MMR缺陷型(d-MMR)CRC的腺瘤-癌序列的演进紧密相关。为了在体外解码其背后的基因突变机理,研究人员选择了类器官模型MLH1KO。此模型通过敲除(KO)MLH1基因,可于体外短期培养中重现d-MMR型CRC突变特征。
本研究中,MLH1KO在体外长期培养并积累了大量的自发突变。研究人员通过在培养基中独立地去除相关通路的生长因子,如Wnt、R-spondin 1、EGF、Noggin;或添加相关通路的抑制因子,如p53抑制剂Nut3,以筛选发生相应突变的类器官并鉴定突变基因。例如,如果Wnt通路激活的基因突变已经在类器官中自发出现,那么即便剥夺培养基中的Wnt生长因子,该类器官的生长也不会受到影响;反之,未发生该突变的类器官则会死亡。
02 Wnt通路突变
肿瘤抑制蛋白APC是Wnt/β-cantenin经典信号通路的负调节因子。在CIN型CRC中,当APC突变失活时,β-cantenin积累、稳定性增加,Wnt通路被激活,继而诱导肿瘤的生长和分化。此前实验中,研究团队已确认,通过在CIN型类器官培养基中去除Wnt-3a和Wnt激活剂R-spondin 1(即-WR培养基),可筛选出APC失活的类器官。本实验中,研究人员利用相同的思路,使用-WR培养基筛选MLH1KO类器官自发积累的突变,最终得到致密且出芽的结构。
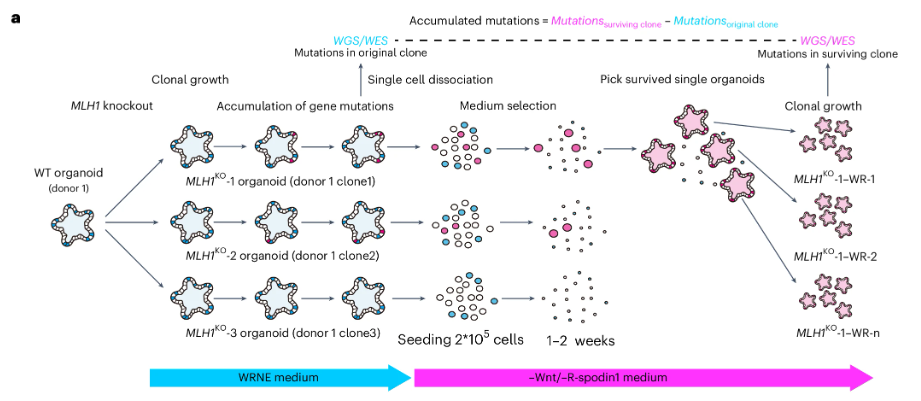
图2:-WR培养基筛选
(来源:参考资料[3])
在同样的抑制或激活干细胞生态位关键通路的培养基中,EGF、BMP和p53通路的筛选均未获取可长期扩增的细胞系,表明在腺瘤-癌序列中,Wnt通路突变必须优先发生。
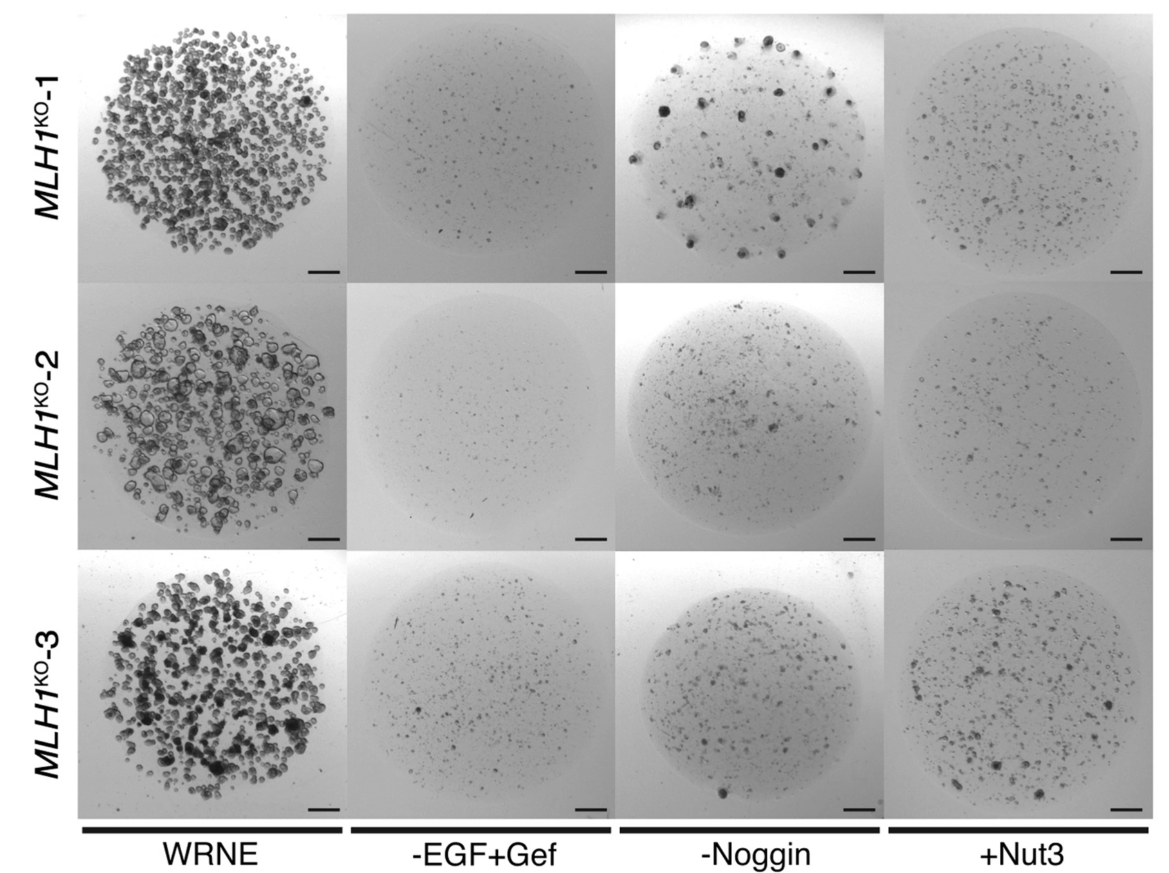
图3:Wnt通路突变优先发生
(来源:参考资料[3])
全基因组测序(WGS)分析发现了两个复合杂合AXIN1突变和一个同源AXIN2突变。这与此前报道的AXIN1和AXIN2双等位基因功能丧失突变可以激活Wnt通路并诱导CRC生长和增殖的结论吻合。研究者随后将AXIN突变亚克隆类器官与APCKO类器官对比,并进行了RT-qPCR分析,确认MLH1KO类器官可作为体外筛查d-MMR缺陷突变基因的平台,其自发突变可用于模拟体外癌症的演化过程。
03 p53及BMP通路突变
在Wnt通路突变的基础上,研究人员展开第二轮筛选。结果发现,去除并抑制EGF的培养基中几乎没有类器官存活。而添加了Nutlins-3的培养基中,只有一个类器官存活并出芽。值得注意的是,添加了BMP通路抑制剂Noggin的培养基有大量类器官存活。
Nutlins-3是蛋白质p53抑制剂。p53也被称作“抑癌蛋白”,当其编码基因TP53突变时,细胞向肿瘤细胞发展。全外显子组测序以及Sanger测序均显示,Nutlins-3挑出的亚克隆类器官中存在TP53的错义突变。
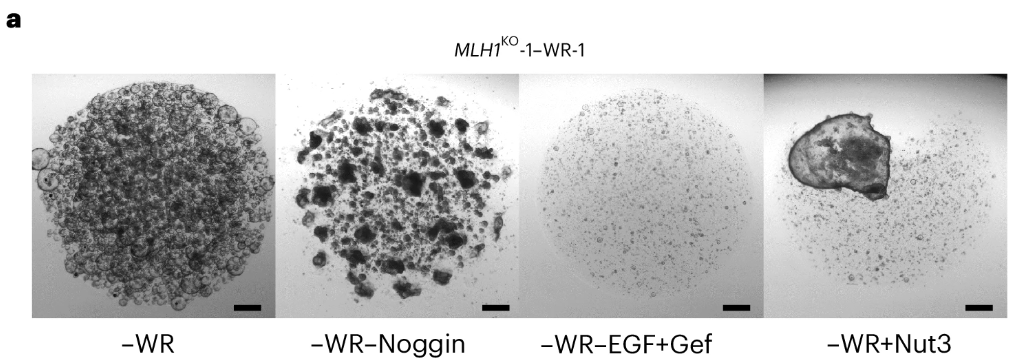
图4:第二次筛选,类器官生长几乎不受Noggin影响,但受Nut3选择
(来源:参考资料[3])
骨形态发生蛋白BMP通路在大多数散发性CRC中失活。类器官培养时则添加抑制剂Noggin以防止类器官过早分化并促进干细胞自我更新。第二轮筛选中,非Noggin依赖的亚克隆类器官里发现了ACVR2A和BMPR2这两类经典的突变,且在不同的亚克隆中,具体发生突变的点位有所差别。而散发性CRC BMP突变中最为常见的SMAD4突变却未被发现。这与此前文章中报道的BMPR2突变与散发性CRC中SMAD4相互排斥的结论符合。
在Wnt和Nut选择后的双突变株系(MLH1KO-1-WR-1+Nu-1)内进行第三次突变筛选,EGFR通路依旧无对应突变出现,通过−Noggin培养基获得了筛选结果。与此前未发生p53突变的非Noggin依赖亚克隆类器官相比,该克隆不携带BMPR 2纯合突变,ACVR2A的突变点位也有所区别。这一结果再次肯定了此前“ACVR2A突变是获得Noggin非依赖性的主要原因,BMPR2起到协同作用”的报道。
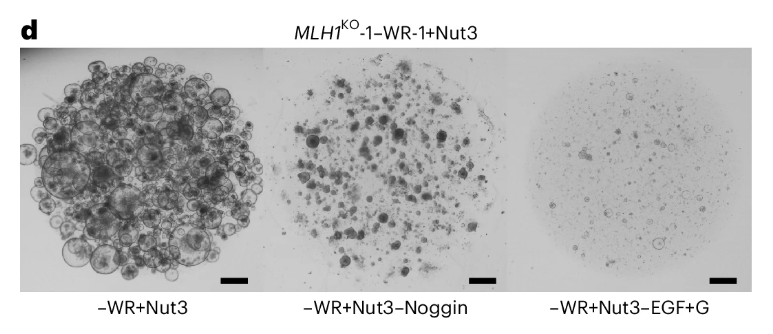
图5:第三次筛选
(来源:参考资料[3])
04 EGFR通路突变
表皮生长因子(EGF)与其受体EGFR结合后,可激活Ras到Raf等一系列通路并影响细胞增殖和细胞周期。在此前的早期选择实验中,均未发现携带EGFR通路突变的亚克隆类器官,研究人员遂在已有的三通路突变的基础之上(MLH1KO-1−WR-1+Nu−N),延长培养时间至300天,在积累更多的突变之后再次进行了选择。
通过向培养基中添加EGFR抑制剂阿法替尼(Afa)和吉非替尼(Gef),最终筛选出RAS突变。RAS基因包含NRAS、HRAS和KRAS,是最常见的致癌基因之一。相较而言,微卫星低度不稳定(MSI-L)内KRAS突变更常见,而NRAS在所有MSI肿瘤中均频繁发生。在本次筛选得到的亚克隆类器官中,发现NRAS杂合体细胞发生已知Ras和Raf通路的致癌突变。
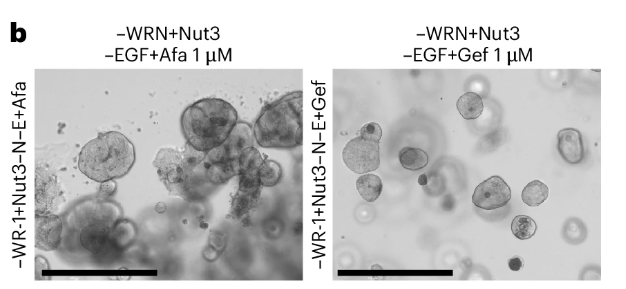
图6:EGFR通路筛选
(来源:参考资料[3])
至此,研究人员构筑起了具有时序性的四通路突变体类器官。在类器官发育过程中,依次发生AXIN1和AXIN2(激活Wnt通路)、TP53(p53失活)、ACVR2A和BMPR2(BMP通路抑制)以及NRAS(激活Ras和Raf通路)突变,使类器官获得MSI-H状态,独立于一系列生长因子,拥有转化为肿瘤细胞的潜能。在不同克隆中独立观察到相同突变的获得,也证明这些突变的独立出现。
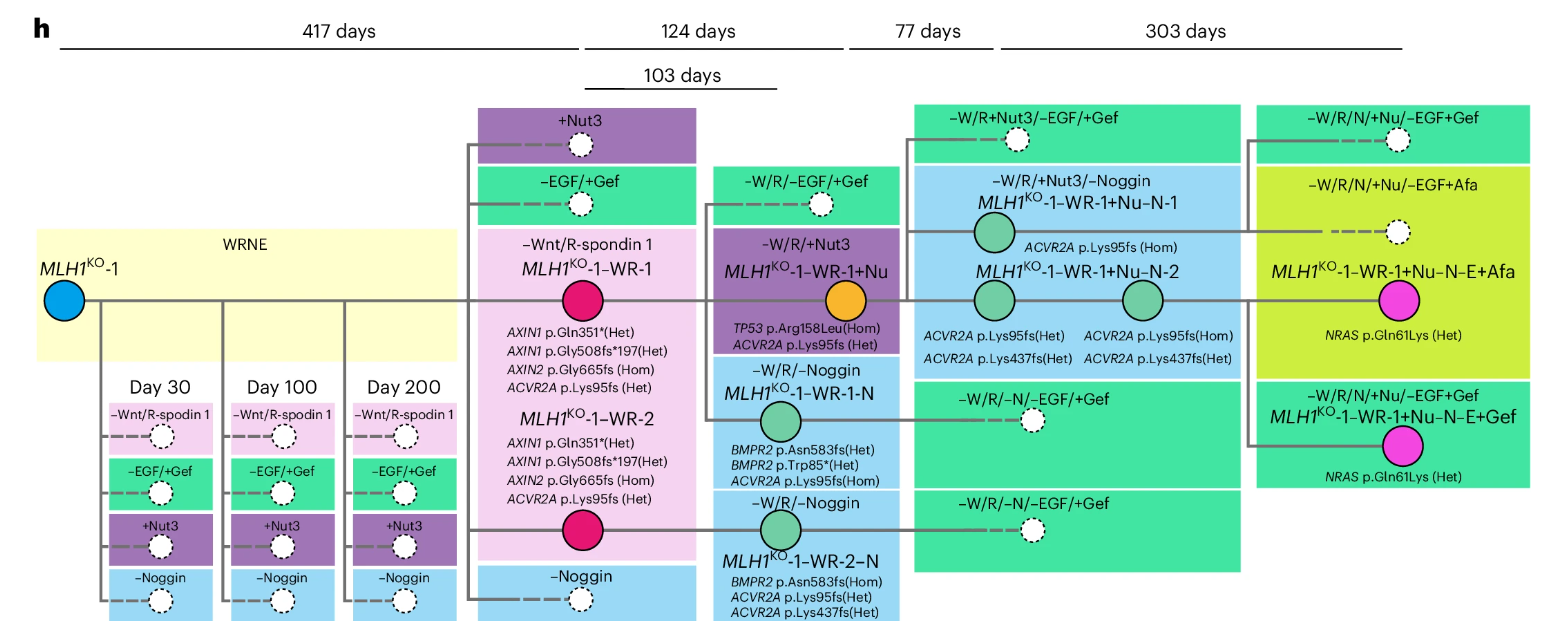
图7:由MLH1KO-1单个类器官克隆产生的所选突变体克隆的时间尺度遗传树
(来源:参考资料[3])
05 异种移植证明体内可致癌
研究人员构建无NRAS突变的三通路突变体类器官(KRASWT)以及四通路突变体(NRASQ61K)等一系列模型,并将其皮下注射到免疫缺陷的小鼠体内。8周的培养后,相较于三通路突变体,四通路突变体克隆具有更高的肿瘤形成率,更大的肿瘤大小,和更高的血管化程度。组织学分析也证实,四通路突变体类器官在异种移植后形成恶性肿瘤。
该结果不仅论证了NRAS突变对于腺瘤-癌序列发展的必要性,也再次表明,自发的四通路突变类器官保留了腺瘤-癌序列发展的能力,是忠实可靠的体外研究模型。
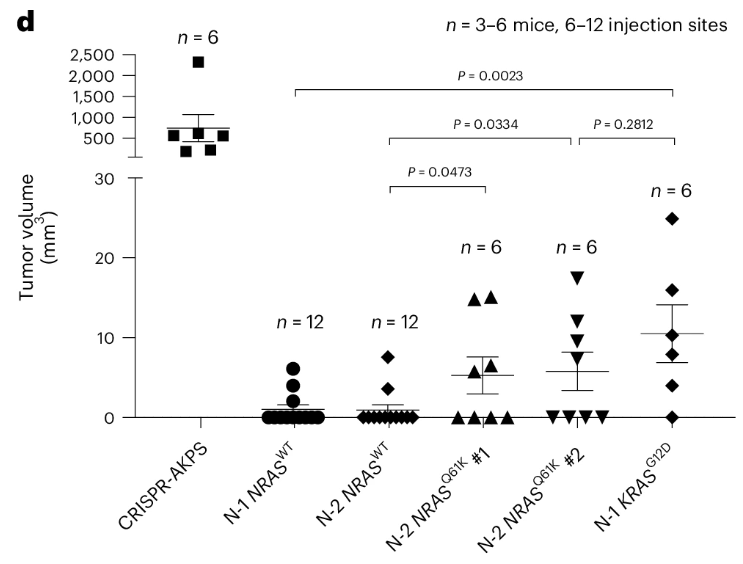
图8:异种移植后8周时异种移植物的肿瘤尺寸
(来源:参考资料[3])
06 总结与展望
在此前的实验中,研究团队已经证实MLH1KO类器官可短期在体外重现d-MMR肿瘤的突变特征。本研究将此结论进一步解析,通过连续剥夺或添加生长因子筛选导致CRC发生的突变。在近1年的长期体外培养实验中,证明CRC发生的第一步突变为AXIN1和AXIN2突变引起的Wnt通路激活,紧随其后的是TP53、BMP通路和EGFR通路的突变。所有结论都证实,MLH1KO类器官可作为MSI-H肿瘤发生的体外模型。且最终筛选得到的四通路突变体克隆皮下移植后也在小鼠体内致癌。
不过,考虑到肿瘤上皮类器官只能评价纯上皮细胞组分,该系统报道肿瘤微环境和免疫应答的能力有限。且囿于近1年的研究时长和规模限制,实验尚无法兼顾检验突变及突变获得顺序的不同组合。研究人员也提到,鉴于CRC的特殊性方便了四种突变通路的选择,目前的MLH1KO类器官模型或难以推广到替他肿瘤类型中。
近岸蛋白具备多种经类器官培养验证的细胞因子,让您的类器官培养更可控!
参考资料
1. Fearon, E R, and B Vogelstein. “A genetic model for colorectal tumorigenesis.” Cell vol. 61,5 (1990): 759-67. doi:10.1016/0092-8674(90)90186-i
2. Menter, David G et al. “Back to the Colorectal Cancer Consensus Molecular Subtype Future.” Current gastroenterology reports vol. 21,2 5. 30 Jan. 2019, doi:10.1007/s11894-019-0674-9
3. Mizutani, Tomohiro et al. “Recapitulating the adenoma-carcinoma sequence by selection of four spontaneous oncogenic mutations in mismatch-repair-deficient human colon organoids.” Nature cancer, 10.1038/s43018-024-00841-x. 1 Nov. 2024, doi:10.1038/s43018-024-00841-x
